Arxiu per abril, 2012
Formulació inorgànica
Conceptes previs
Subst├áncies elementals: s├│n les que estan constitu├»des per ├átoms d’un element, constitueixen la mol├¿cula de l’element.
A. Substàncies monoatòmiques: es representen i nomenen igual que els elements solen
ser metalls i gasos nobles. Ex. Na, Fe, He.
B. Subst├áncies poliat├▓miques: es donen en els no metalls per nomenar-les en la nomenclatura tradicional s’utilitza el nom com├║ i en la sistem├ática es posa el nom de l’element amb un prefix numeral que indica el n├║m. d’├átoms presents.
Prefixos numerals
Exemples:
| Mico ÔÇô 1 | Hexa ÔÇô 6 |
| DiÔÇô 2 | Hepta ÔÇô 7 |
| Tri ÔÇô 3 | Octa ÔÇô 8 |
| Tetra ÔÇô 4 | Nona ÔÇô 9 |
| Penta ÔÇô 5 | Deca ÔÇô 10 |
| Tradicional | Sistemàtica | |
| Cl2 | Clor | Diclor |
| I2 | Iode | Diiode |
| O3 | Oz├│ | Trioxigen |
| P4 | F├▓sfor blanc | Tetraf├▓sfor |
Hidrurs
S├│n combinacions de l’H amb un altre element. La val├¿ncia de l’hidrogen ├®s +1 amb els no metalls i ÔÇô1 amb els metalls.
A. Hidrurs no met├ál┬Àlics (hidr├ácids).
B. Altres hidrurs no met├ál┬Àlics.
C. Hidrurs met├ál┬Àlics.
Hidrurs no met├ál┬Àlics
S├│n combinacions d’H +1 amb (F, Cl, Br, I) -1 i (S, Es, Et) -2.
La part (+) a l’esquerra i la (-) a la dreta en els compostos binaris, es creuen les
valències i se simplifiquen.
Nomenclatura tradicional: Es posa la paraula ├ácid i a continuaci├│ l’arrel o nom del no metall acabat en ÔÇôh├¡dric.
Nomenclatura sistem├ática: a l’arrel llatina o nom del no metall acabat en ÔÇôur i a continuaci├│ la preposici├│ dÔÇÖ i la paraula hidrogen.
F├│rmula general
Hx A
| Tradicional | Sistemàtica | |
| HF | ├Çcid fluorh├¡dric | Fluorur dÔÇÖhidrogen |
| H2S | ├Çcid sulfh├¡dric | Sulfur dÔÇÖhidrogen |
| HCl | ├Çcid clorh├¡dric | Clorur dÔÇÖhidrogen |
Altres hidrurs no met├ál┬Àlics
S├│n combinacions de l’H +1 amb N, P, As, Sb, B, C, Si.
Nomenclatura tradicional: Noms comuns sense regles.
Nomenclatura sistem├ática: A la paraula hidrur se li posa un prefix numeral que indiqui el n├║m. d’H, a continuaci├│ la preposici├│ d’ i el nom del no metall.
Exemples:
| Tradicional | Sistemàtica | |
| BH3 | Borà | Trihidrur de bor |
| CH4 | Metà | Tetrahidrur de carboni |
| SiH4 | Silà | Tetrahidrur de silici |
| NH3 | Amoníac | Trihidrur de nitrogen |
| PH3 | Fosfina | Trihidrur de f├▓sfor |
| AsH3 | Arsina | Trihidrur d’ars├¿nic |
| SbH3 | Estibina | Trihidrur d’antimoni |
Hidrurs met├ál┬Àlics
S├│n combinacions de l’H -1 amb un metall.
Nomenclatura tradicional: sÔÇÖanomena amb la paraula Hidrur seguit de la preposici├│ d’ i el nom o arrel llatina del metall acabat en ÔÇôic quan el metall vagi amb la val├¿ncia major o en ÔÇô├│s quan la que actua ├®s la menor.
Quan el metall tingui una sola val├¿ncia es posa la paraula hidrur, despr├®s la preposici├│ d’ i el nom del metall o b├® lÔÇÖarrel o el nom del metall acabat en -ic.
Nomenclatura d’estoc: sÔÇÖanomena amb la paraula hidrur seguit de la preposici├│ d’ i a continuaci├│ en n├║m. romans i entre par├¿ntesi el nom del metall. Si el metall t├® nom├®s una val├¿ncia no se sol posar.
Nomenclatura sistem├ática: a la paraula hidrur se li posa un prefix numeral que indiqui el n├║m. d’H presents, a continuaci├│ la preposici├│ de seguida del nom de el metall.
F├│rmula general
A Hx
| Tradicional | Estoc | Sistemàtica | |
| NaH | Hidrur s├▓dic o de sodi | Hidrur de sodi | Hidrur de sodi |
| CaH2 | Hidrur de calci | Hidrur de calci | Dihidrur de calci |
| CuH | Hidrur cupr├│s | Hidrur de coure (I) | Hidrur de coure |
| CoH3 | Hidrur cobàltic | Hidrur de cobalt | Trihidrur de cobalt |
Òxids
S├│n combinacions d’O2 amb la resta dels elements. La val├¿ncia de l’O ├®s ÔÇô2.
En la formula general es porta a l’O sempre a la dreta les val├¿ncies intercanviades i se
simplifica tot el que es pot.
Hi ha dos tipus d’├▓xids els met├ál┬Àlics ( b├ásics ) i els no met├ál┬Àlics ( ├ácids ).
├Æxids met├ál┬Àlics
S├│n combinacions de l’O2 amb metalls.
Nomenclatura tradicional: sÔÇÖanomenen igual que els hidrurs met├ál┬Àlics per├▓ canviant hidrur per ├▓xid.
Nomenclatura d’estoc: igual que els hidrurs met├ál┬Àlics per├▓ canviant la paraula hidrur per ├▓xid.
Nomenclatura sistem├ática: igual que els hidrurs met├ál┬Àlics per├▓ canviant la paraula hidrur per ├▓xid i posant-li al nom del metall un prefix numeral que indiqui el n├║m. Del metall.
Exemples:
| Tradicional | Estoc | Sistemàtica | |
| Na2O | Òxid sòdic | Òxid de sodi | Òxid de disodi |
| CaO | Òxid càlcic | Òxid de calci | Òxid de calci |
| Cu2O | Òxid cuprós | Òxid de coure (I) | Òxid de dicoure |
| Co2O3 | Òxid cobàltic | Òxid de cobalt(III) | Triòxid de dicobalt |
├Æxids no met├ál┬Àlics o ├▓xids ├ácids
S├│n combinacions de l’O amb un no metall.
Per distingir les valències se segueixen les següents regles:
2 val├¿ncies:┬á ÔÇô├│s (menor) i ÔÇôic (major).
3 val├¿ncies: ┬áhipo- ? -├│s (menor); -├│s (intermitja); ÔÇôic (major).
4 val├¿ncies┬á hipo- ? -├│s (menor); -├│s (2a); ÔÇôic (3a); per- ? ÔÇôic (major).
F├│rmula general
A2 Ox
Nomenclatura tradicional: igual que els ├▓xids met├ál┬Àlics amb les seves terminacions corresponents.
Nomenclatura d’estoc: id├¿ntic als ├▓xids met├ál┬Àlics.
Nomenclatura sistem├ática: id├¿ntic als ├▓xids met├ál┬Àlics.
Exemples:
| Tradicional | Estoc | Sistemàtica | |
| Cl2O | Òxid hipoclorós | Òxid de clor (I) | Òxid de diclor |
| CO2 | Òxid carbònic | Òxid de carboni (IV) | Diòxid de carboni |
| SO2 | Òxid sulfurós | Òxid de sofre (IV) | Diòxid de sofre |
| Cl2O5 | Òxid clòric | Òxid de clor (V) | Pentaòxid de diclor |
| Cl2O7 | Òxid perclòric | Òxid de clor (VII) | Heptaòxid de diclor |
Per├▓xids
S├│n combinacions de l’i├│ per├▓xid O2 -2 amb metalls el 2 de l’i├│ no se simplifica mai.
Nomenclatura tradicional: igual que els ├▓xids met├ál┬Àlics posant el prefix per-
Nomenclatura d’estoc: id├¿ntic que els ├▓xids met├ál┬Àlics posant el prefix per-.
Nomenclatura sistem├ática: igual que els ├▓xids met├ál┬Àlics.
Exemples:
| Tradicional | Estoc | Sistemàtica | |
| H2O2 | Per├▓xid d’hidrogen | Per├▓xid d’hidrogen (I) | Di├▓xid de dihidro |
| CaO2 | Per├▓xid de calci | Per├▓xid de calci (II) | Di├▓xid de calci |
| CuO2 | Per├▓xid c├║pric | Per├▓xid de coure (II) | Di├▓xid de coure |
| SnO2 | Per├▓xid estan├│s | Per├▓xid d’estany (II) | Di├▓xid d’estany |
| Na2O2 | Per├▓xid de sodi | Per├▓xid de sodi (I) | Di├▓xid de disodi |
Sals binàries
S├│n compostos formats per un metall amb un no metall, dos metalls o b├® dos no metalls.
Les valències es creuen i se simplifiquen si es pot.
F├│rmula general
MyAx
Nomenclatura tradicional: s’escriu el nom o arrel llatina del no metall acabat en ÔÇôur i a continuaci├│ si el metall nom├®s t├® una val├¿ncia es posa la preposici├│ d’ i el nom del metall o del metall acabat en ÔÇôic, si per contra el metall t├® dues val├¿ncies es posa l’arrel del metall acabat en -├│s per a la menor i en ÔÇôic per a la major.
Nomenclatura d’estoc: al nom o arrel del no metall acabat en ÔÇôur segueix la preposici├│ d’ i el nom del metall amb la seva val├¿ncia en n├║m. romans i entre par├¿ntesi.
Nomenclatura sistem├ática: es posa l’arrel o nom del no metall acabat en -ur, li segueix la preposici├│ d’ i el nom del metall. S’indica amb un prefix numeral el n├║m. de metalls i no metalls presents.
Exemples:
| Tradicional | Estoc | Sistemàtica | |
| LiF | Fluorur de liti o lític | Fluorur de liti | Fluorur de liti |
| AlCl3 | Clorur d’alumini | Clorur d’alumini | Triclorur d’alumini |
| CoS | Sulfur cobalt├│s | Sulfur de cobalt (II) | Sulfur de cobalt |
| Au Br3 | Bromur ├áuric | Bromur d’or (III) | Tribromur d’or |
| K2S | Sulfur de potassi | Sulfur de potassi | Sulfur de dipotassi |
No metall amb no metall
S├│n iguals que els anteriors.
Exemples:
| Tradicional | Estoc | Sistemàtica | |
| IBr3 | Bromur iod├│s | Bromur de iode (III) | Tribromur de iode |
| PCl5 | Clorur fosf├▓ric | Clorur de fosforo (V) | Pentaclorur de f├▓sfor |
| CCl4 | Clorur carb├▓nic | Clorur de carboni (IV) | Tetraclorur de carboni |
| BP | Fosfur de bor | Fosfur de bor | Fosfur de bor |
Metall amb metall
Tamb├® seÔÇÖn diuen aliatges.
Cu-Zn Llaut├│
Fe-C Acer
Pb-Sn Soldadura
Cu-Sn Bronze
Ni-Cr-Fe Nicrom
Ni-Fe Permalloy
Cu-Zn-Ni Plata alemanya
Cu-Ni Constantan
Al-Cu-Mn-Mg Duralumini
Hidr├▓xids
S├│n composts formats per el ÔÇôi├│ hidr├▓xid i un metall.
OH ÔÇô1 el grup t├® val├¿ncia negativa.
F├│rmula general
A (OH)x
En el cas que x sigui un el parèntesi no se sol posar.
Nomenclatura tradicional: sÔÇÖanomena igual que els ├▓xids met├ál┬Àlics canviant ├▓xid per hidr├▓xid.
Nomenclatura d’Estoc: igual que els ├▓xids met├ál┬Àlics per├▓ canviant ├▓xid per hidr├▓xid.
Nomenclatura sistemàtica: es canvia òxid per hidròxid.
Exemples:
| Tradicional | Estoc | Sistemàtica | |
| NaOH | Hidr├▓xid de sodi | Hidr├▓xid de sodi | Hidr├▓xid de sodi |
| Ni(OH)2 | Hidròxid niquelós | Hidròxid de níquel (II) | Dihidròxid de niquel |
| Al(OH)3 | Hidr├▓xid d’alumini | Hidr├▓xid d’alumini(III) | Trihidr├▓xid d’alumini |
| Sn(OH)4 | Hidr├▓xid est├ánnic | hidr├▓xid d’estany (IV) | Tetrahidr├▓xid d’estany |
Oxoàcids
Són compostos ternaris que contenen un àtom central oxigen i hidrogen, aquest darrer es pot canviar per metall.
F├│rmula general
Hx Ay Oz
Nomenclatura tradicional: es nomenen igual que us ├▓xids met├ál┬Àlics canviant la paraula ├▓xid per ├ácid.
Nomenclatura sistem├ática: es posa un prefix numeral que indiqui el n├║m. dÔÇÖox├¡gens i a continuaci├│ la paraula ÔÇôoxo, nom o arrel llatina de l’├átom central acabat en ÔÇôlligo, despr├®s la val├¿ncia d’├átom central en n├║m. romans i entre par├¿ntesi, despr├®s la preposici├│ d’ i la paraula hidrogen, despr├®s de la paraula ÔÇôoxo- es posa un prefix numeral que indiqui el n├║m. d’├átoms centrals.
Exemples:
| Tradicional | Sistemàtica | |
| HClO | ├Çcid hipoclor├│s | Oxoclorat (I) d’hidrogen |
| H2SO4 | ├Çcid sulf├║ric | Tetraoxosulfat (VI) d’hidrogen |
| HBrO3 | ├Çcid br├▓mic | Trioxobromat (V) d’hidrogen |
| HNO2 | ├Çcid nitr├│s | Dioxonitrat (III) d’hidrogen |
Procediment per formular oxoàcids
A partir del nom
- Triar el n├║mero dÔÇÖoxidaci├│ que hem de fer servir fixant-nos amb els pre/sufixos.
- Formular lÔÇÖ├▓xid amb el n├║mero dÔÇÖoxidaci├│ triat.
- Simplificar si es pot.
- Sumar una mol├¿cula dÔÇÖaigua
- Escriure la f├│rmula mantenint lÔÇÖordre seg├╝ent: Hx Ay Oz
- Simplificar si es pot.
A partir de la f├│rmula
- Comprovar que la fórmula no està simplificada; si ho està, obtenir la fórmula sense simplificar (la fórmula no està simplificada quan: H2 Ay Oz).
- Restar una mol├¿cula dÔÇÖaigua.
- Comprovar que la fórmula no està simplificada; si ho està, obtenir la fórmula sense simplificar (la fórmula no està simplificada quan: A2 Oz).
- Segons el n├║mero dÔÇÖ├átoms que tingui lÔÇÖoxigen (Oz) podrem saber el n├║mero dÔÇÖoxidaci├│.
- Triar el pre/sufix segons el n├║mero dÔÇÖoxidaci├│ obtingut i escriure el nom de la f├│rmula.
Oxosals
Es poden anomenar tamb├® sals neutres. S├│n composts formats per un metall un compost normal no met├ál┬Àlic normalment i O2 . S├│n el resultat de substituir tots els H d’un oxo├ácid per un metall.
F├│rmula general
Mx (Ay Oz)m
M = n├║m. d’H substu├»ts.
m = valència del metall
x i m se simplifiquen quan es pot.
Si x val o en simplificar surt 1 el parèntesi no es posa.
La part entre par├¿ntesi ├®s la part negativa, sempre va junta i correspon a un ani├│, el metall ser├á la part positiva i per tant, el cati├│.
Nomenclatura tradicional: anomenem primer l’ani├│, per a aix├▓ s’elimina la paraula ├ácid i es canvia la terminaci├│ ÔÇôic per ÔÇô at i la terminaci├│ ÔÇô├│s per ÔÇôit; a continuaci├│ sÔÇÖanomena el metall amb les mateixes regles que els ├▓xids.
Correspondència entre els pre/sufixos dels oxoàcids i les oxosals:
Hipo- ? ÔÇô├│s ┬¡┬¡┬¡┬¡———├á┬á┬á┬á Hipo- ? – it
-├│s —————— ├á┬á┬á┬á┬á┬á┬á┬á┬á ┬á┬á┬á -it
-ic —————-├á┬á┬á┬á┬á -at
Per- ? ÔÇôic ——–├á┬á┬á┬á Per- ? -at
Nomenclatura sistemàtica: igual que els oxàcids canviant el nom hidrogen pel metall
amb la val├¿ncia d’aquesta en n├║m. romans i entre par├¿ntesi. Si la val├¿ncia ├®s ├║nica no es posa.
Exemples:
| Tradicional | Estoc | Sistemàtica | |
| FePO4 | Fosfat fèrric | Fosfat de ferro (III) | Tetraoxofosfat (V) de ferro |
| Fe2(SO4)3 | Sulfat fèrric | Sulfat de ferro (III) | Tris [tetraoxosulfat (VI)] de ferro (III) |
Procediment per formular oxosals
A partir del nom
- Formular lÔÇÖoxo├ácid corresponent a lÔÇÖoxosal (aix├▓ ho pots fer mirant la correspond├¿ncia de pre/sufixos)
- Triar el n├║mero dÔÇÖoxidaci├│ que hem de fer servir fixant-nos amb els pre/sufixos.
- Formular lÔÇÖ├▓xid amb el n├║mero dÔÇÖoxidaci├│ triat.
- Simplificar si es pot.
- Sumar una mol├¿cula dÔÇÖaigua
- Escriure la f├│rmula mantenint lÔÇÖordre seg├╝ent: Hx Ay Oz
- Simplificar si es pot.
- Substituir lÔÇÖhidrogen pel metall i posar el n├║m. dÔÇÖoxidaci├│ corresponent a lÔÇÖani├│: Hx Ay Oz —├á Mx (Ay Oz)m
- Simplificar si es pot (x i m).
A partir de la f├│rmula
- Comprovar que la fórmula no està simplificada; si ho està, obtenir la fórmula sense simplificar (la fórmula no està simplificada quan: Mx (Ay Oz)m).
- Troba lÔÇÖoxo├ácid corresponent a lÔÇÖoxosal (aix├▓ ho pots fer substituint el metall per un hidrogen: Mx (Ay Oz)m —├á Hx Ay Oz)
- Restar una mol├¿cula dÔÇÖaigua.
- Comprovar que la fórmula no està simplificada; si ho està, obtenir la fórmula sense simplificar (la fórmula no està simplificada quan: A2 Oz).
- Segons el n├║mero dÔÇÖ├átoms que tingui lÔÇÖoxigen (Oz) podrem saber el n├║mero dÔÇÖoxidaci├│.
- Triar el pre/sufix segons el n├║mero dÔÇÖoxidaci├│ obtingut i escriure el nom de la f├│rmula tenint en compte el n├║mero dÔÇÖoxidaci├│ del metall.
La hidrosfera terrestre
La hidrosfera ├®s el conjunt d’aigua que existeix al planeta Terra, en qualsevol dels tres estats (s├▓lid, l├¡quid i gas├│s). La hidrosfera ocupa prop de les tres quartes parts de la superf├¡cie de la Terra. El gruix d’aquesta capa varia des d’uns cent├¡metres en un toll fins a prop d’11 Km. a les fosses oce├ániques.
Hem de diferenciar entre aigua dol├ºa i salada ja que nom├®s podem aprofitar la dol├ºa. D’aquesta aigua dol├ºa la major part es troba en estat s├▓lid en els pols o ├®s aigua subterr├ánia. L’aigua dol├ºa en estat l├¡quid no arriba a lÔÇÖ1% del total.
Aigua líquida
- Aigua salada (mars i oceans) — aprox. 97%
- Aigua dol├ºa (aigues substerr├ánies, rius, llacs) — menys de l’1%
Aigua s├▓lida
- Neu o gel: en els Pols o als cims de les muntanyes — aprox. 2%
Aigua gas
- Vapor d’aigua: a l’atmosfera — 0,001%
L’AIGUA I LA VIDA
Sense aigua en estat líquid no hauria sorgit la vida.
- L’aigua ├®s el medi on va sorgir la vida.
- L’aigua constitueix la major part de qualsevol organisme viu.
- L’aigua ├®s el mitj├á en el qual tenen lloc la major part dels processos que mantenen la vida.
- L’aigua ├®s indispensable per a la reproducci├│ de la majoria dels organismes.
- Els animals prenen l’aigua de l’exterior mitjan├ºant ingesti├│ directa de l├¡quids o a trav├®s dels aliments. Els vegetals obtenen l’aigua absorbint-la per les arrels.
- Els ├®ssers vius tamb├® perden aigua per transpiraci├│, respiraci├│, per l’excreci├│ i en la formaci├│ de la femta.
- ├ës fonamental que existeixi un balan├º adequat entre la ingesti├│ i la p├¿rdua d’aigua perqu├¿ l’organisme no es deshidrati.
- En l’├®sser hum├á, a m├®s, l’aigua afavoreix la regulaci├│ de la temperatura mitjan├ºant la suor, l’eliminaci├│ de subst├áncies┬á per l’orina, etc. Per aconseguir un bon equilibri org├ánic, l’adult ha d’ingerir uns 3 litres d’aigua diaris a trav├®s dels aliments s├▓lids i l├¡quids.
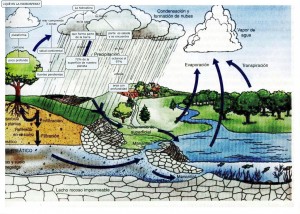
EL CICLE DE L’AIGUA
L’aigua al nostre planeta aquesta en continu moviment a causa de l’energia del sol i a l’atracci├│ gravitat├▓ria. L’aigua dels rius, llacs i mars de la Terra s’escalfa amb el sol. Aix├▓ fa que es vagi evaporant i pujant cap amunt. La transpiraci├│ de les plantes tamb├® aporta vapor d’aigua a l’atmosfera. Aix├¡ es formen els n├║vols. Quan els n├║vols estan molt plens de vapor d’aigua i pesen molt, es produeix la pluja. Si la temperatura ├®s baixa l’aigua cau en forma de neu o de calamarssa. Aix├▓ succeeix una vegada despr├®s d’una altra, donant lloc al que es coneix com el cicle de l’aigua.
LÔÇÖaigua de pluja que cau sobre la superf├¡cie terrestre pot:
- Disc├│rrer formant petits rierols, torrents o rius.┬á S├│n aig├╝es de vessament superficial. L’aigua circula des de la part alta del terreny cap a les baixes, acabant al mar, on de nou es pot evaporar a causa de l’energia solar.
- Una altra part de les aig├╝es de pluja s’infiltren a trav├®s dels porus i esquerdes del terreny formant les aig├╝es d’infiltraci├│ o aig├╝es subterr├ánies. Aquestes aig├╝es de vegades surten a la superf├¡cie formant deus.
Aquest cicle fa que l’aigua dissolgui i arrossegui materials des de les zones m├®s altes a les m├®s baixes on se dipositen.
LES PRECIPITACIONS
L’atmosfera cont├® aigua. El vapor d’aigua que hi ha a l’aire ├®s la humitat.
Els n├║vols s├│n acumulacions de petites gotes d’aigua o b├® de diminutes part├¡cules de gla├º. Es formen quan l’aire humit ascendeix i es refreda. El vapor d’aigua es condensa i es formen petites gotes d’aigua que queden suspeses en l’aire. Si la temperatura ├®s molt baixa, en lloc de gotes d’aigua l├¡quida es formen petits cristalls de gla├º. De vegades, els n├║vols es formen arran de terra: ├®s la boira.
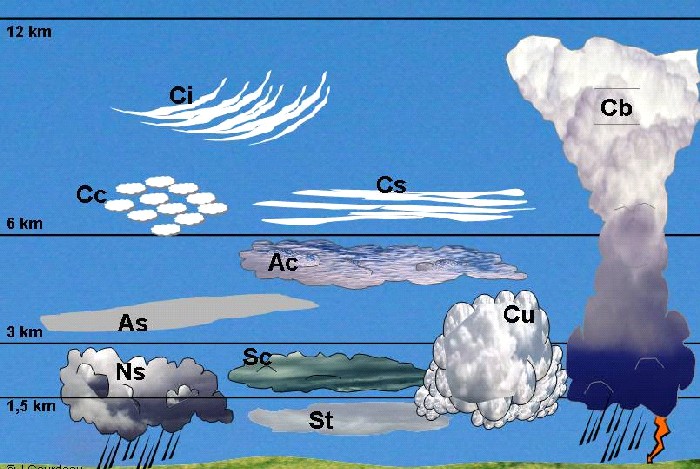
TIPUS DE NÚVOLS
Els cirrus s├│n n├║vols alts. La seva pres├¿ncia indica la pres├¿ncia de vapor d’aigua en el nivells alts de l’atmosfera. La seva forma indica en quina direcci├│ bufa el vent en zones altes.
Si els cirrus procedents del sud-est al nord-oest que sÔÇÖespesseixen paulatinament, cal esperar un empitjorament del temps en les pr├▓ximes 48 hores.
Si durant una situació de bon temps, estan repartits de forma irregular per tot el cel, no existeix cap causa  per un ràpid empitjorament del temps.
El temps millorar├á si els cirrus venen de lÔÇÖest i romanen estables en el cel o incl├║s desapareixen.
LÔÇÖobservaci├│ dels cirrus ├®s una ajuda apropiada pels alpinistes de grans altures, permetent recon├¿ixer amb antelaci├│ un empitjorament del temps.
Els estrats baixos estan formats per gotetes dÔÇÖaigua, per├▓ si les temperatures s├│n extremadament baixes poden estar formats tamb├® fins cristalls de gel. Se solen formar a les cadenes muntanyoses i a les costes. SÔÇÖoriginen en les nits clares i amb una elevada humitat ambiental a lÔÇÖestiu. Generalment, porten pluges moderades per├▓ que duren uns dies.
Si apareixen a lÔÇÖestiu hi ha masses dÔÇÖaire c├álid i humitat; formaci├│ dÔÇÖuna tempesta .
Si s├│n n├║vols fibrosos acompanyen moltes vegades als n├║vols de pluja.
La boira ├®s la manifestaci├│ m├®s coneguda dels estrats. En un espai de molts dies cobreix el paisatge i deprimeix lÔÇÖ├ánima de les persones.
Els c├║muls s├│n n├║vols baixos que solen portar pluges abundants.
Els c├║muls es poden transformar en cumulonimbes que s├│n una formaci├│ nuvolosa t├¡pica de les tempestes. SÔÇÖeleven a gran altura. Les tempestes s├│n pluges intenses que van acompanydaes de llamps i trons. Aix├▓ ├®s perqu├¿ a l’interior d’aquests n├║vols hi ha forts corrents d’aire ascendents que fan que les part├¡cules d’aigua i de gla├º es carreguin el├¿ctricament pel fregad├¡s i produeixin llamps. Els llamps van acompanyats d’un soroll que ├®s el tro.
La pluviositat ├®s la quantitat de pluja caiguda en un lloc determinat. Es mesura en mm o en L/m2 o en dies o expressada pel nombre de dies en qu├¿ ha plogut durant un any. L’instrument que ens permet mesurar-la ├®s el pluvi├▓metre.
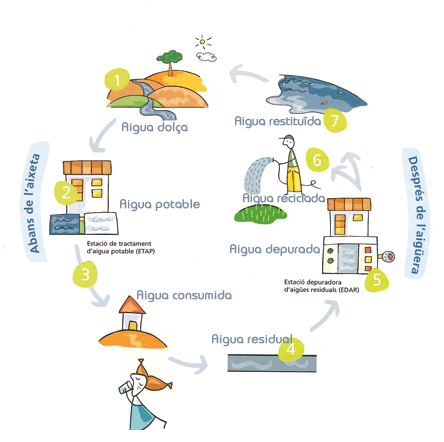
L’AIGUA POTABLE
L’aigua que bevem les persones ├®s l’aigua potable. L’aigua potable que consumim prov├® dels rius, els pantans i lÔÇÖaigua subterr├ánia.
Malgrat aix├▓, l’aigua d’aquests llocs cont├® gran quantitat de subst├áncies que poden provocar malalties en les persones i animals que la beuen. Per poder beure l’aigua sense perill, aquesta ha de sotmetre’s a un proc├®s de neteja o potabilitzaci├│, al final del qual obtindrem aigua potable.
- L’aigua potable ├®s transparent, i no t├® subst├áncies que facin mal a l’organisme, ni olor, ni color ni sabor.
- L’aigua potable ├®s aquella que pot fer-se servir per a l’├║s hum├á sense cap risc per a la salut.
- ├ës important├¡ssim no malgastar l’aigua potable i fer-ne un bon ├║s, perqu├¿ ├®s un b├® necessari per viure.
Per poder portar l’aigua als habitatges s’han de solucionar els problemes de: captaci├│ de l’aigua, potabilitzaci├│, distribuci├│ de l’aigua potable, recollida d’aig├╝es residuals, depuraci├│ d’aquestes i abocament de l’aigua depurada.
La potabilitzaci├│ de l’aigua ├®s transformar-la adequadament per al consum hum├á, eliminant les impureses nocives. Les aig├╝es naturals poden contenir tres tipus d’impureses:
- Sals dissoltes.
- S├▓lids en suspensi├│.
- Gèrmens patògens.
Depuraci├│ d’aig├╝es residuals
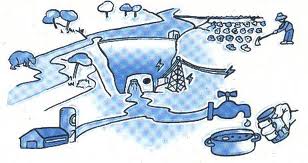
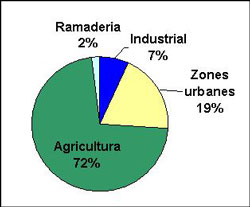
USOS DE L’AIGUA
- ├Üs dom├¿stic: per rentar-nos, netejar, el bany, la rentadora, etc. L’aigua bruta cont├® sab├│ i altres productes qu├¡mics.
- ├Üs agr├¡cola: utilitzada en els conreus. L’aigua bruta cont├® fertilitzants, insecticides, etc.
- ├Üs industrial: utilitzada a les ind├║stries, maquin├ária, etc. L’aigua bruta cont├® olis, productes qu├¡mics i fins i tot, radioactius.
Per tant, en utilitzar l’aigua l’embrutem. Aquesta aigua bruta rep el nom d’aig├╝es residuals i no poden ser abocades als rius i mars, ja que les subst├áncies que contenen s├│n t├▓xiques i alterarien el medi natural (farien que morissin els peixos, que no ens pogu├®ssim banyar a les platges, etc.). Per aquest motiu, les aig├╝es residuals han de passar per una estaci├│ depuradora per assegurar la seva neteja i evitar danys al medi ambient.
CICLE URB├Ç DE L’AIGUA
DEURES 1r d’ESO
Aquesta ├®s la feina que heu de fer avui:
1. L’efecte hivernacle (consultar la informaci├│ que hi ha al bloc i el que hi ha al llibre)
Exercici 4, pàg. 137
2. Fes una representaci├│ a la llibreta de la Rosa dels Vents (busca informaci├│ per internet)
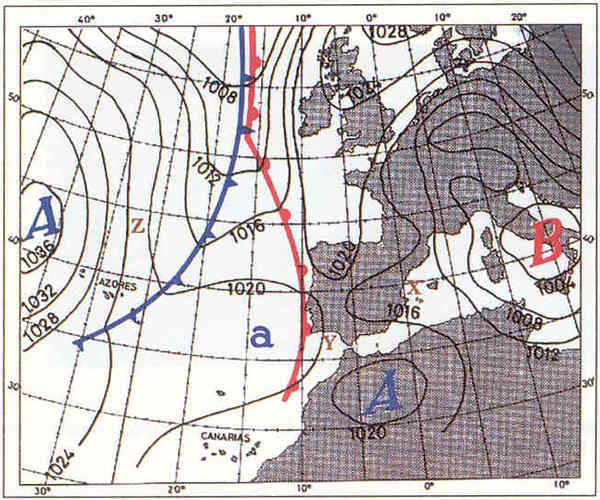
3. Interpreta el següent mapa del temps (quin temps farà, si hi haurà anticicló o borrasca, si plourà, els fronts, etc.)
DEURES 3r d’ESO
Aquesta ├®s la feina que heu de fer avui:
- Fer els apunts del sistema nervi├│s que corresponen als apartats:
1. El funcionament del sistema nervi├│s
2. Les respostes del sistema nervi├│s
- Podeu trobar la informació en el bloc de naturals i en el llibre digital (Funció de relació, el sistema nerviós, pàg. 26-33 i 39.
- Exercici de reforç, els moviments voluntaris pàg. 89