Arxius per ‘Naturals 1r ESO’ Category
DEURES 1r d’ESO
Aquesta és la feina que heu de fer avui:
1. L’efecte hivernacle (consultar la informació que hi ha al bloc i el que hi ha al llibre)
Exercici 4, pàg. 137
2. Fes una representació a la llibreta de la Rosa dels Vents (busca informació per internet)
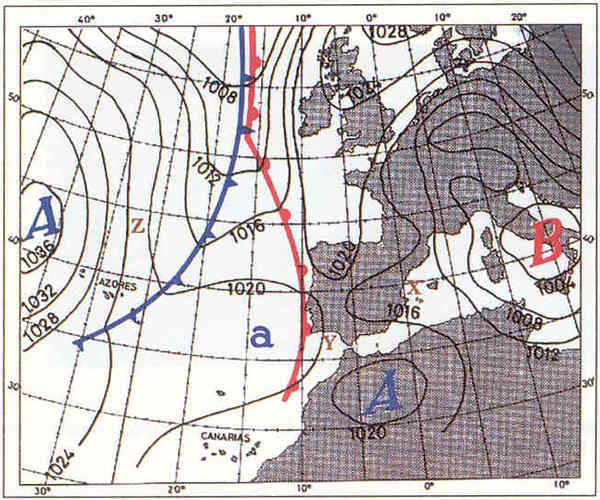
3. Interpreta el següent mapa del temps (quin temps farà, si hi haurà anticicló o borrasca, si plourà, els fronts, etc.)
L’atmosfera terrestre
L’atmosfera és la capa gasosa que envolta la Terra. Està formada per una barreja de gasos denominada aire.
LA COMPOSICIÓ DE L’AIRE
La composició de l’aire és la següent:
- 78,1% de Nitrogen (N2)
- 20,9% d’Oxigen (O2)
- 0,93% d’Argó (Ar)
- 0,035% de Diòxid de carboni (CO2)
- 0,035% de neó, heli i altres gasos
NITROGEN
És un gas que a temperatura ambient no reacciona amb altres substàncies pel que no pot ser aprofitat per les plantes ni els animals, només alguns pocs microorganismes ho poden captar.
OXIGEN
És el gas que permet la respiració d’animals i plantes, és a dir és el gas que reacciona amb les molècules procedents dels aliments generant energia vital i CO2. A partir de l’oxigen (O2) es forma l’ozó (O3) que protegeix els organismes de les mutacions cancerígenes que provoquen els raigs ultraviolats.
ARGÓ, NEÓ I HELI
Són gasos que no reaccionen amb altres substàncies (són gasos nobles) per la qual cosa no influeixen en la vida dels organismes.
DIÒXID DE CARBONI
És el gas que capten les plantes per a produir la matèria orgànica mitjançant la fotosíntesi. També és el que desprenen animals i plantes al respirar i el que es produeix en incendis i combustions. Aquest gas permet l’entrada de les radiacions solars però no la sortida de la calor que desprenen les roques i l’aigua escalfada. A causa de aquest fenomen, anomenat efecte hivernacle, l’augment del CO2 produït per la combustió del petroli i del carbó està provocant l’escalfament del planeta i s’està produint un canvi climàtic.
REACCIONS D’OXIDACIÓ
RESPIRACIÓ CEL·LULAR
Els organismes heteròtrofs necessiten alimentar-se de matèria orgànica, és a dir, alimentar-se d’altres organismes, ja siguin vius o morts. En una primera etapa es produeix la digestió dels aliments fins arribar a unes molècules petites (nutrients) capaços d’entrar en les cèl•lules. Dintre d’elles, en uns orgànuls anomenats mitocondris, reaccionen amb l’oxigen (l’anomenada respiració cel•lular), alliberant l’energia que precisa l’ésser viu. La resta de les molècules de nutrients s’utilitzen per a crear reserves d’energia o per a generar estructures i així créixer. La reacció química de la respiració cel•lular és:
Matèria orgànica + oxigen —> Matèria inorgànica (diòxid de carboni + aigua) + Energia
COMBUSTIÓ
La combustió és un fenomen químic que es produeix quan cremen determinades substàncies combustibles – fusta, carbó, oli o alcohol -, i produeix llum, calor i gasos, que transformats en flames consumeixen tota la matèria fins deixar-la reduïda a cendres.
La corrosió és el tercer tipus de reacció d’oxidació. Es produeix per la reacció química de l’oxigen amb un metall. Per exemple, la corrosió del ferro consisteix en la transformació del ferro en òxid de ferro, quan reacciona amb l’oxigen.
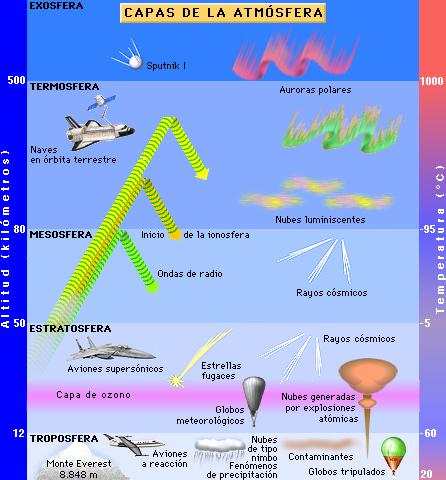
L’ESTRUCTURA DE L’ATMOSFERA
A l’atmosfera es poden diferenciar cinc capes en funció de la seva composició en gasos i de la seva temperatura. Es recomana estudiar-les començant per la capa inferior, la troposfera, que és en la que vivim, i continuar en ordre ascendent.
TROPOSFERA
Arriba fins els 13 km. Conté el 80% dels gasos i gairebé tot el vapor d’aigua. En ella cada 100 m més d’alçada la temperatura descendeix 0,65 ºC arribant a -60 ºC als 13 km. Predominen els moviments verticals d’aire, com les anomenades corrents de convecció. En ella es produeixen les precipitacions (pluges i nevades).
ESTRATOSFERA
Comença als 13 km i arriba fins els 50 km. En ella predominen els moviments horitzontals de l’aire, d’aquí el seu nom. Conté la capa d’ozó que absorbeix les radiacions UV, reacció que desprèn energia, la qual cosa fa augmentar la temperatura d’uns -60 ºC als 13 km fins quasi els 80 ºC als 50 km.
MESOSFERA
Comença als 50 km i arriba fins els 80 km. És una capa sense ozó ni vapor d’aigua. En ella els meteorits es posen incandescents i es produeixen les estels fugaços. La temperatura descendeix d’uns 80 ºC als 50 km fins -80 ºC als 80 km.
IONOSFERA
Comença als 80 km i arriba fins els 500 km. A mesura que s’ascendeix la temperatura passa d’uns -80 ºC a més de 1000 ºC. Conté partícules carregades d’electricitat (ions), d’aquí el nom d’ionosfera. Reflecteix les ones de ràdio i en ella es produeixen les aurores boreals que s’observen des de les zones polars.
EXOSFERA
És la capa més externa de l’atmosfera. Comença a partir dels 500 km d’alçada. Presenta poques molècules d’aire i molt separades, per la qual cosa és molt difícil saber on acaba (aproximadament deu arribar als 2000 km).
Si voleu veure el següent video aneu a l’enllaç: http://educacion.practicopedia.com/ciencias-naturales/como-es-la-estructura-de-la-atmosfera-terrestre-10713
LA CONTAMINACIÓ DE L’AIRE
Hem vist que l’aire està format per la barreja d’una sèrie de gasos. Però en l’aire (sobretot en zones industrialitzades) conté altres substàncies contaminants. Els clorofluorocarbonis (CFC) utilitzats en aerosols, frigorífics i condicionadors d’aire;
òxids de sofre (originats en la combustió del carbó) i els òxids de nitrogen (originat en els motors dièsel) que juntament amb el vapor d’aigua donen lloc a substàncies àcides que cauen amb la pluja, l’anomenada pluja àcida, que acidifica el sòl i mata a les plantes;
carbonet de la combustió i la pols de les pedreres que provoquen malalties de les vies respiratòries i al•lèrgies, i les dioxinesque són substàncies produïdes en la incineració d’escombraries que afavoreixen l’aparició de càncers.
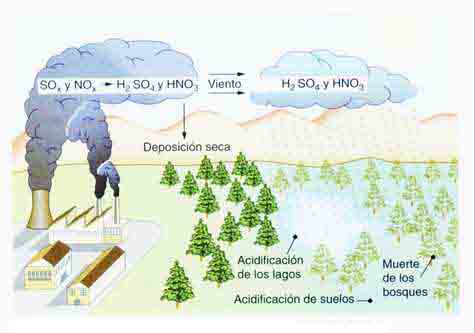
LA PLUJA ÀCIDA
La pluja àcida és una conseqüència de la presència d’òxids de sofre i de nitrogen a l’atmosfera generats en activitats de combustió per produir energia. Els òxids de sofre es produeixen en la combustió de carbó o de petroli; els òxids de nitrogen es produeixen en totes les combustions especialment en les dels motors dels vehicles.
Els òxids de sofre i nitrogen, en combinar-se amb l’aigua de l’atmosfera, formen petites gotes d’aigua que contenen àcid sulfúric i àcid nítric. Aquestes gotes poden créixer fins a convertir-se en gotes de pluja. Si aquesta pluja és rica en àcid sulfúric té un pH molt baix, inferior a 4,5, i aleshores es parla de pluja àcida.
La pluja àcida té efectes negatius sobre la vegetació i ecosistemes aquàtics associats. La pluja àcida crema les fulles dels arbres i les plantes provocant la seva defoliació. També augmenta l’acidesa de l’aigua del sòl, la qual cosa provoca una mala absorció de sals i aigua per les plantes a través de les arrels i la mort de molts organismes que no poden suportar aquesta acidesa.
 A continuació teniu un video que us ajudarà a entendre la pluja àcida:
A continuació teniu un video que us ajudarà a entendre la pluja àcida:
LA DESTRUCCIÓ DE LA CAPA D’OZÓ
Alguns gasos com els clorofluorocarbonis (CFC) utilitzats en aerosols, frigorífics i condicionadors d’aire destrueixen l’ozó, per la qual cosa s’aprima la capa d’ozó. Aquest aprimament es coneix amb el nom “forat de la capa d’ozó”. La capa d’ozó es troba a l’estratosfera i ens protegeix d’un excès de radiació solar.
En el següent video podeu veure una explicació sobre aquest fet:
Mireu el video per veure com ha evolucionat la destrucció de la capa d’ozó:
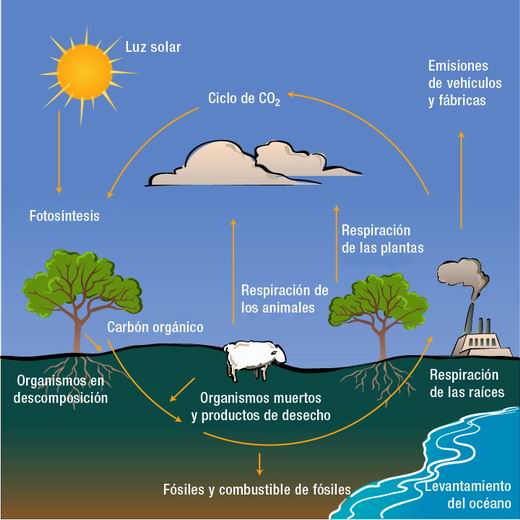
L’EFECTE HIVERNACLE
La temperatura de la Terra és perfecta per a la vida. Ni massa freda, com a Mart, ni massa calenta com a Venus. Gràcies a aquestes condicions la vida s’estén per tot el nostre planeta.
La Terra s’escalfa gràcies a l’energia del Sol. Una part d’aquesta energia que arriba a l’atmosfera és reflectida en direcció a l’espai, una altra part molt petita és absorbida i la resta travessa l’atmosfera i escalfa la Terra.
Però quan l’energia és reflectida des de la Terra es produeix un fenomen diferent. Alguns gasos de l’atmosfera, com el CO2 i el vapor d’aigua, la retenen, absorbeixen gran part de l’energia i eviten que torni a l’espai. Això contribueix a mantenir el planeta calent.
Així, doncs, l’atmosfera deixa passa la radiació del Sol per tal que escalfi la Terra, però impedeix que la radiació de la Terra escapi a l’espai. És molt semblant al que passa als hivernacles, amb la diferència que l’hivernacle utilitza el vidre i no pas els gasos de l’atmosfera per retenir l’escalfor. Per això aquest fenomen natural ha rebut el nom d’efecte hivernacle. Si l’escalfor no restés retinguda a l’atmosfera, la Terra es glaçaria.
Aquí podeu veure un video explicatiu:
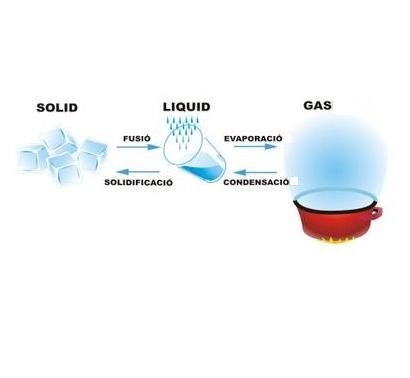
Canvis físics i químics
En aquesta unitat estudiarem els canvis físics i els canvis químics. Els canvis físics es caracteritzen perquè no modifiquen la naturalesa de la substància i en canvi, els canvis químics sí que modifiquen la naturalesa de les substàncies de manera que se’n formen de noves amb propietats diferents.
Per exemple, els canvis d’estat de l’aigua són exemples de canvis físics ja que tant el gel, com l’aigua líquida com el vapor són la mateixa molècula d’aigua i podem tornar a l’estat inicial fàcilment (canvis reversibles). També són exemples de canvis físics les mescles, les dissolucions i la separació de substàncies en mescles o dissolucions.
En canvi, en els canvis químics desapareixen unes substàncies i se’n creen altres de noves amb propietats molt diferents. Aquest procés s’anomena reacció química: una o més substàncies, anomenades reactius, es transformen en una o més substàncies amb propietats diferents, anomenades productes. Aquest procés és difícilment reversible.
ACTIVITAT
(Llegeix atentament l’enunciat!)
Digues si els processos següents corresponen a canvis físics o químics i explica quina transformació s’ha donat en cada cas:
a) Una porta de ferro rovellada
b) El desgel de les muntanyes a la primavera
c) Posar sal i oli a l’aigua per cuinar
d) Una foguera
e) Aigua bullint
Pràctiques a 1r d’ESO:SEPARACIÓ DE MESCLES
Avui els alumnes de 1r d’ESO han fet les pràctiques de separació de mescles. Aquesta vegada no hem anat al laboratori sinó que hem convertit l’aula en un taller de ciència.
Han pogut experimentaramb les tècniques que han estudiat a classe. Aquí teniu una mostra dels experiments que han fet!!!
IMANTACIÓ
Separació d’una mescla heterogènia de llimadures de ferro i sofre mitjançant un iman.
EVAPORACIÓ
Separació d’una solució aquosa de sal mitjançant l’evaporació.
DECANTACIÓ
Separació d’una emulsió d’oli i aigua mitjançant un embut de decantació.
Separació dels colorants de la tinta de bolígraf mitjançant la cromatografia en paper.
Pràctiques de 1r d’ESO: SOLUCIONS I MESCLES
Els alumnes de 1r han realitzat les pràctiques de laboratori ,que consistien en la preparació de solucions i mescles.
La primera pràctica consistia en calcular la concentració d’una dissolució i veure que la solubilitat depèn del tipus de solut i d’altres factors físics, com ara la temperatura. Aquests experiments els han realitzat en solucions aquoses de sal i sucre.
En la segona han preparat diverses mescles: suspensions (farina i aigua, xocolata i aigua) i emulsions (oli i vinagre).
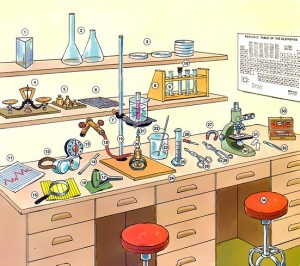
PRÀCTIQUES DE LABORATORI
Com cada curs els alumnes de Ciències de la Naturalesa de 1r i 3r d’ESO realitzaran les pràctiques de laboratori. L’objectiu d’aquestes pràctiques és apropar als alumnes el que és realment la ciència: veure, tocar, observar i experimentar tot allò que han après a classe de manera teòrica.
Primer de tot, cal que coneguin la normativa de seguretat d’un laboratori per tal de treballar segurs i de manera addient. També els servirà per familiaritzar-se amb el material i instrumental del laboratori així com també per aprendre a seguir protocols i dur a terme experiments relacionats amb el tema que estudien a classe.
Mescles i solucions: problemes
Aquests són els problemes de deures pel dia 13 de desembre:
1. Tenim 20 g de sal fins a obtenir 500 mL de solució.
a) Calcula la concentració (g/L i g/mL)
b) Quina massa hauríem d’agafar si volem 200 mL de solució?
2. Com prepararies 250 cm3 d’una solució de sucre i aigua d’una concentració de 5 g/L?Q
3. Quines quantitats de sal i aigua barrejaries per obtenir 300 g d’una solució al 15%?
4. Quin és el percentatge en volum d’una solució que conté 100 cm3 d’alcohol i 300 mL d’aigua?
5.Com prepararies 25 mL d’una solució d’alcohol en aigua del 12% en volum?